Efecto del protector de membrana y la solución descongelante en la calidad in vitro del semen caprino congelado en pastillas
Contenido principal del artículo
Resumen
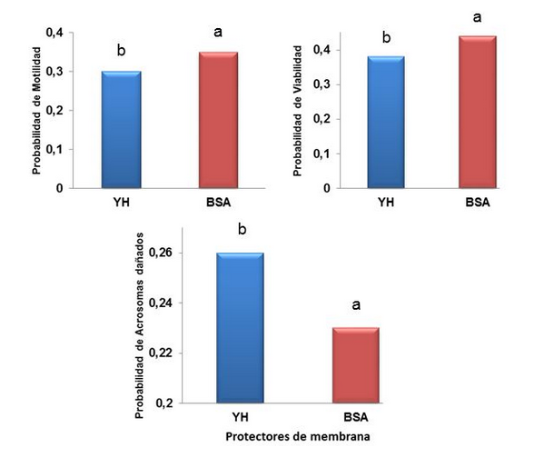
Esta investigación se realizó con el objetivo de evaluar el efecto del protector de membrana y la solución descongelante en la calidad in vitro del semen caprino congelado en pastillas. Se procesaron 214 eyaculados, colectados dos veces por semana mediante Vagina Artificial. Se evaluaron los parámetros volumen, motilidad, concentración, viabilidad y anomalías espermáticas totales. Los eyaculados aptos fueron mezclados y divididos en dos porciones; cada una recibió la formulación correspondiente sin realizar el lavado seminal por centrifugación. Se utilizó un diluyoconservador liofilizado no comercial compuesto por Tris-Glucosa-Ácido Cítrico y Glicerol, con diferentes protectores de membrana, yema de huevo (4,45%) o BSA (5%). Se congeló en vapores de nitrógeno, en pastillas de 0,1 mL y se almacenaron en nitrógeno líquido durante siete días. Para la descongelación, se utilizaron dos soluciones (Tris y CIMATO) y un control (tubo seco sin solución descongelante). Se determinó en test de incubación, porcentaje de motilidad (30, 120 y 240 minutos), viabilidad y acrosomas dañados (30 y 120 minutos). El protector de membrana, la solución descongelante y sus interacciones se compararon mediante un modelo de Regresión Logística Binaria. La combinación de BSA y el CIMATO presentaron la mayor probabilidad (P<0,05) de motilidad y viabilidad en todos los tiempos y la menor probabilidad (P<0,05) de acrosomas dañados a 30 min y 120 min. Se concluye que la BSA puede utilizarse como protector de membrana, para la congelación del semen caprino en pastillas en un diluyoconservador liofilizado a base de Tris, sin realizar el lavado seminal por centrifugación y la solución CIMATO, como descongelante, posibilita mejor recuperación de la célula espermática.
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0) que prohíbe el uso comercial de sus publicaciones y permite a terceros compartir la obra siempre que se indique su autor y la primera publicación en esta revista. Bajo esta licencia el autor será libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
- El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia
Bajo las siguientes condiciones:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
Citas
Grötter LG, Cattaneo L, Marini PE, Kjelland ME, Ferré LB. Recent advances in bovine sperm cryopreservation techniques with a focus on sperm post‐thaw quality optimization. Reprod Domest. An. 2019;54(4):655-665. https://doi.org/10.1111/rda.13409
Ntemka A, Tsakmakidis IA, Kiossis E, Milovanović A, Boscos CM. Current status and advances in ram semen cryopreservation. J Hellenic Vet Med Soc. 2018;69(2):911-924. https://ejournals.epublishing.ekt.gr/index.php/jhvms/article/view/18014
Peris-Frau P, Soler AJ, Iniesta-Cuerda M, Martín-Maestro A, Sánchez-Ajofrín I, Medina-Chávez DA, et al. Sperm cryodamage in ruminants: understanding the molecular changes induced by the cryopreservation process to optimize sperm quality. Int. J. Mol. Sci. 2020;21(8):2781. https://doi.org/10.3390/ijms21082781
Sun L, Fan W, Wu C, Zhang S, Dai J, Zhang D. Effect of substituting different concentrations of soybean lecithin and egg yolk in tris-ased extender on goat semen cryopreservation. Cryobiology. 2020;92:146-150. DOI:10.1016/j.cryobiol.2019.12.004
Aitken RJ. Impact of oxidative stress on male and female germ cells: implications for fertility. Reproduction, 2020;159(4):189-201. https://doi.org/10.1530/REP-19-0452
Kumar A, Prasad JK, Srivastava N, Ghosh SK. Strategies to Minimize Various Stress-Related Freeze-Thaw Damages During Conventional Cryopreservation of Mammalian Spermatozoa. Biopreservation and Biobanking. 2019;17(6):603-612. http://doi.org/10.1089/bio.2019.0037
Karunakaran M, Devanathan TG. Evaluation of bull semen for fertilityassociated protein, in vitro characters and fertility. J Appl Anim Res. 2017;45:136-144. DOI:10.1080/09712119.2015.1129343.
Santiago-Moreno J, Galarza DA. Sperm cryopreservation in domestic and wild species: a review of recent advances. Rev Ec Ciencia An. 2019;3(2):18-38. ISSN 2602-8220.
Zamiri MJ. Update on semen cryopreservation in sheep and goats: A review. Journal of livestock science and technologies. 2020;8(1):1-15. DOI:10.22103/jlst.2020.15927.1321.
Khan IM, Cao Z, Liu H, Khan A, Rahman SU, Khan MZ, et al. Impact of Cryopreservation on Spermatozoa Freeze-Thawed Traits and Relevance OMICS to Assess Sperm Cryo-Tolerance in Farm Animals. Front. Vet. Sci. 2021;8:609180. DOI: 10.3389/fvets.2021.609180
Sharma A, Sood P. Cryopreservation and fertility of frozen thawed Chegu goat semen. Indian J. Anim. Res. 2019; 53(11): 1414-1419. DOI:10.18805/ijar.B-3696
Martínez-Durán J, Duverger-Tellez O, Díaz-Martínez N, Interian-Alvarez L, Denis-García R, Palacios-Espinosa A. Effect of the sperm membrane protector on the freezability of goat semen. Tropical and Subtropical Agroecosystems. 2022;25(2). https://www.revista.ccba.uady.mx/ojs/index.php/TSA/article/view/4011
Sandal AI, Senlikci H, Baran A, Ozdas OB. Effects of semen extender supplemented with Bovine Serum Albumin (BSA) on spermatological traits of Saanen buck semen stored at +4°C. Kafkas Univ Vet Fak Derg. 2020;26(4):515-520. DOI: 10.9775/kvfd.2019.23674.
Sharma A, Sood P. Caprine semen cryopreservation and the factors affecting it: An overview. Veterinary Sciences: Research and Reviews. 2020;6(1):46-57. http://dx.doi.org/10.17582/journal.vsrr/2020/6.1.46.57
Satorre MM, Breininger E. Effect of packaging method on quality and functional parameters in cryopreserved porcine spermatozoa with alpha tocopherol. Research in Veterinary Science and Medicin. 2021;1(1):1-6. DOI:10.25259/RVSM_4_2020.
Khalifa TAA, El-Saidy BE. Pellet-freezing of Damascus goat semen in a chemically defined extender. An Reprod Sci. 2006;93:303-315. DOI: 10.1016/j.anireprosci.2005.08.008
Minitab 19. Software estadístico, State College, Pensilvania: Minitab, Inc. 2019. www.minitab.com
- Agossou DJ, Koluman N. An Objective Analysis of Factors Affecting Buck Semen Quality Attributes during Cryopreservation:A Mini Review. Annual Research & Review in Biology, 2018;27(3):1-7. DOI: 10.9734/ARRB/2018/42087
Raheja N, Choudhary S, Grewal S, Sharma N, Kumar N. A review on semen extenders and additives used in cattle and buffalo bull semen preservation. J. Entomol. Zool. Stud. 2018;6(3):239-245.
Gangwar C, Kharche SD, Kumar S, Jindal SK. Cryopreservation of goat semen: status and prospects. Indian Journal of Small Rum. 2016;22(1):1-10. DOI: 10.5958/0973-9718.2016.00005.2
Silva ECB, Lima RA, Guerra MMP. Goat semen freezing: the two faces of the coin. An. Sci. 2021;31(1):134-144. http://www.uece.br/cienciaanimal/index.php?option=com_docman&task=doc_view&gid=797&tmpl=component&format=raw&Itemid=157
Mahdi SAAW, Mahmood FA, Mahmoo RM. Effect of different concentrations of Bovine Serum Albumin on some of the frozen sperm characteristics of the rams. Plant Archives. 2019;19(2):1486-488.
Alcay S, Toker MB, Gokce E, Onder NT, Ustuner B, Nur Z. Long term incubation resilience of post-thaw ram semen diluted with lecithin-based extender supplemented with Bovine Serum Albumin. Kafkas Univ Vet Fak Derg. 2019;25(3):291-297. https://doi.org/10.9775/kvfd.2018.20843
Uysal O, Bucak MN. Effects of oxidized glutathione, bovine serum albumin, cysteine and lycopene on the quality of frozen-thawed ram semen. Acta Vet Brno. 2007;76:383-390. https://doi.org/10.2754/avb200776030383
Bustani GS, Baiee FH. Semen extenders: An evaluative overview of preservative mechanisms of semen and semen extenders, Veterinary World. 2021;14(5):1220-1233. doi: doi.org/10.14202/vetworld.2021.1220-1233
Isachenko V, Sanchez R, Rahimi G, Mallmann P, Isachenko E, Merzenich M. Cryoprotectant-free vitrification of spermatozoa: Fish as a model of human. Andrologia. 2019;51(1):e13166. https://doi.org/10.1111/and.13166
Fhulufhelo RV, Khoboso L, Tshimangadzo N. Cryopreservation of South African Indigenous Goat Semen. Alemania. Ed. Lambert Academic Publishing (LAP). 2012. ISBN 10: 3848442469 / ISBN 13: 9783848442461.
Evans G, Maxwell WMC. Frozen storage of semen. In: Salamon's Artificial Insemination of Sheep and Goats. Butterworths, Wellington. 1987;122-141. ISBN: 9780409491777
Yamashiro H, Wang H, Yamashita Y, Kumamoto K, Terada T. Enhanced Freezability of Goat Spermatozoa Collected into Tubes Containing Extender Supplemented with Bovine Serum Albumin (BSA). J. Reprod. Dev. 2006;52(3):407-414. DOI:10.1262/jrd.17105.
Martínez J, Interián L, Valdés M, Milanés C, Collazo J. Influencia del protector de la membrana espermática, el crioprotector y la solución descongelante en la congelabilidad del semen caprino. Rev. Cub. Reprod. Anim. 2004;30(1-2):81-89.
Hezavehei M, Sharafi M, Kouchesfahani HM, Henkel R, Agarwal A, Esmaeili V, et al. Sperm cryopreservation: A review on current molecular cryobiology and advanced approaches. Reprod Biomed Online. 2018;37(3):327-339. DOI: 10.1016/j.rbmo.2018.05.012
Viotty G. Procesamiento del semen bovino para la Inseminación Artificial. Tesis Doctoral. Univ. Montevideo, Fac. Vet., Uruguay. 2012.
Duverger O, Moya A, Barba FJ, Hernández JJ. Nuevos diluyentes y descongelantes para semen bovino. Rev. Cub. Cient. Vet. 1988;19(1):19-28.
Awad MM, Graham JK. A new pellet technique for cryopreserving ram and bull spermatozoa using the cold surface of cattle fat. Animal Reproduction Science. 2004;84:83-92. https://doi.org/10.1016/j.anireprosci.2003.12.001
Moraes C, Neves J, Goncalves P, Oliveira J, Schweitzer C. Criopreservacao do semen ovino en pellets. Ciencia Rural. 1998;28(2):287-292. https://doi.org/10.1590/S0103-84781998000200018
Saadeldin IM, Khalil WA, Alharbi MG, Lee SH. The Current Trends in Using Nanoparticles, Liposomes, and Exosomes for Semen Cryopreservation. Animals. 2020;10(12):2281. DOI:10.3390/ani10122281