Vitrificación de embriones pre-implantatorios como método simple para la protección y generación de ratones transgénicos
Contenido principal del artículo
Resumen
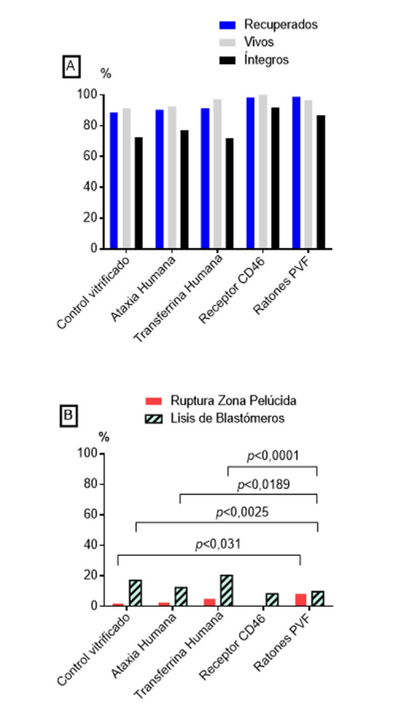
La vitrificación de embriones y gametos es una novedosa alternativa para la protección ex situ y generación de ratones transgénicos. Un primer objetivo de este trabajo fue demostrar la efectividad de la vitrificación de embriones en 4-células con el propósito de conservar el genofondo de cuatro líneas de ratones transgénicos: 1) Ataxia, 2) Transferrina humana, 3) receptor CD46 y 4) ratones transgénicos que expresan la proteína verde fluorescente (PVF); un segundo objetivo, fue obtener crías transgénicas a partir de embriones pronucleares vitrificados y modificados genéticamente por lentitransgénesis. En ambos experimentos fueron utilizados como grupo control embriones obtenidos de ratones no transgénicos. Los embriones en los estadios 4-células y pronucleares fueron obtenidos a las 55 h y 18 h post tratamiento superovulatorio, en cada caso. Los embriones colectados fueron vitrificados en sus correspondientes mezclas de DMSO, etilen glicol y sucrosa, y conservados en nitrógeno líquido hasta su uso. Post descongelación fue evaluada la supervivencia in vitro e in vivo en cada grupo experimental y se determinaron los principales daños citoestructurales que sufrieron los embriones. En el primer grupo experimental, los embriones vitrificados en estadio de 4-células, se logró una alta tasa de supervivencia embrionaria post descongelación en las cuatro líneas transgénicas (rango 91,5% a 100%). En el caso del desarrollo in vivo, no se observaron diferencias significativas en los porcentajes de crías nacidas viables entre las líneas transgénicas Ataxia 49,5%, Transferrina 47%, Receptor CD46 24,4% vs control vitrificado 38,3% (p<0,05), respectivamente). Como principales daños citoestructurales se observó la ruptura de la zona pelúcida y lisis de blastómeros, con porcentajes que difieren entre grupos. En el caso de los embriones pronucleares se obtuvo una tasa de desarrollo in vivo de 19,9% de crías viables (n=52 crías nacidas/ 266 embriones transferidos). De éstas un 25% de las crías obtenidas fueron transgénicas (n=13/52), para una eficiencia general por lentitransgénesis utilizando embriones pronucleares vitrificados de 4,5% (n=13/266). Los resultados obtenidos corroboran la efectividad de la vitrificación de embriones con fines de protección de genofondos y la generación de ratones modificados genéticamente por lentitransgénesis.
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0) que prohíbe el uso comercial de sus publicaciones y permite a terceros compartir la obra siempre que se indique su autor y la primera publicación en esta revista. Bajo esta licencia el autor será libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
- El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia
Bajo las siguientes condiciones:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
Citas
Bolton R.L., Mooney A., Pettit M.T., Bolton A.E., Morgan L., Drake G.J., et al. Resurrecting biodiversity: advanced assisted reproductive technologies and biobanking. Reprod Fertil. 2022;3(3):R121-R46.
Holt W.V., Comizzoli P. Genome resource banking for wildlife conservation: promises and caveats. Cryo Letters. 2021;42(6):309-20.
Leibo S.P., Sztein J.M. Cryopreservation of mammalian embryos: Derivation of a method. Cryobiology. 2019;86:1-9.
Awasthi P.R., French C.F., Sztein J., Bedigian R., Sharp J.J., Lloyd K.C. Frozen sperm as an alternative to shipping live mice. Contemp Top Lab Anim Sci. 2003;42(5):8-11.
Agca Y., Agca C. Cryopreservation and Transplantation of Laboratory Rodent Ovarian Tissue for Genome Banking and Biomedical Research. Methods Mol Biol. 2021;2180:469-83.
Takeo T., Nakao S., Nakagawa Y., Sztein J.M., Nakagata N. Cryopreservation of mouse resources. Lab Anim Res. 2020;36:33.
Shaw J.M., Nakagata N. Cryopreservation of transgenic mouse lines. Methods Mol Biol. 2002;180:207-28.
Hart-Johnson S., Mankelow K. Archiving genetically altered animals: a review of cryopreservation and recovery methods for genome edited animals. Lab Anim. 2022;56(1):26-34.
Boubelik M., Cerna Z. A modified two-step method for cryopreservation of mouse embryos for purposes of embryo banking. Folia Biol (Praha). 1993;39(4):211-9.
Taft R. Mouse Embryo Cryopreservation by Slow Freezing. Cold Spring Harb Protoc. 2018;2018(5).
Shaw J.M., Diotallevi L., Trounson A.O. A simple rapid 4.5 M dimethyl-sulfoxide freezing technique for the cryopreservation of one-cell to blastocyst stage preimplantation mouse embryos. Reprod Fertil Dev. 1991;3(5):621-6.
Trounson A., Peura A., Kirby C. Ultrarapid freezing: a new low-cost and effective method of embryo cryopreservation. Fertil Steril. 1987;48(5):843-50.
Oikonomou Z, Chatzimeletiou K, Sioga A, Oikonomou L, Tarlatzis B.C., Kolibianakis E. Effects of vitrification on blastomere viability and cytoskeletal integrity in mouse embryos. Zygote. 2017;25(1):75-84.
Ghandy N, Karimpur Malekshah A.A. Which Stage of Mouse Embryos Is More Appropriate for Vitrification? Int J Fertil Steril. 2017;10(4):357-62.
Shaw J.M., Jones G.M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Hum Reprod Update. 2003;9(6):583-605.
Vajta G. Vitrification of the oocytes and embryos of domestic animals. Anim Reprod Sci. 2000;60-61:357-64.
Ali J, Shelton J.N. Vitrification of preimplantation stages of mouse embryos. J Reprod Fertil. 1993;98(2):459-65.
Nakao K, Nakagata N, Katsuki M. Simple and efficient vitrification procedure for cryopreservation of mouse embryos. Exp Anim. 1997;46(3):231-4.
Zhou G.B., Hou Y.P., Jin F, Yang Q.E., Yang Z.Q., Quan G.B., et al. Vitrification of mouse embryos at various stages by open-pulled straw (OPS) method. Anim Biotechnol. 2005;16(2):153-63.
Zhang J, Cui J, Ling X, Li X, Peng Y, Guo X, et al. Vitrification of mouse embryos at 2-cell, 4-cell and 8-cell stages by cryotop method. J Assist Reprod Genet. 2009;26(11-12):621-8.
Kaneko T, Nakagawa Y. Genome editing of rodents by electroporation of CRISPR/Cas9 into frozen-warmed pronuclear-stage embryos. Cryobiology. 2020;92:231-4.
Keskintepe L, Agca Y, Pacholczyk G.A., Machnicka A, Critser J.K. Use of cryopreserved pronuclear embryos for the production of transgenic mice. Biol Reprod. 2001;65(2):407-11.
Bagis H, Odaman H, Sagirkaya H, Dinnyes A. Production of transgenic mice from vitrified pronuclear-stage embryos. Mol Reprod Dev. 2002;61(2):173-9.
Maemura M, Taketsuru H, Nakajima Y, Shao R, Kakihara A, Nogami J, et al. Totipotency of mouse zygotes extends to single blastomeres of embryos at the four-cell stage. Sci Rep. 2021;11(1):11167.
Markoulaki S, Meissner A, Jaenisch R. Somatic cell nuclear transfer and derivation of embryonic stem cells in the mouse. Methods. 2008;45(2):101-14.
Sung LY, Chang CC, Amano T, Lin CJ, Amano M, Treaster SB, et al. Efficient derivation of embryonic stem cells from nuclear transfer and parthenogenetic embryos derived from cryopreserved oocytes. Cell Reprogram. 2010;12(2):203-11.
Montoliu L. Transgenesis and Genome Engineering: A Historical Review. Methods Mol Biol. 2023;2631:1-32.
Aguiar J, Fernandez J, Aguilar A, Mendoza Y, Vazquez M, Suarez J, et al. Ubiquitous expression of human SCA2 gene under the regulation of the SCA2 self promoter cause specific Purkinje cell degeneration in transgenic mice. Neurosci Lett. 2006;392(3):202-6.
Perera Y, Cobas K, Garrido Y, Nazabal C, Brown E, Pajon R. Determination of human transferrin concentrations in mouse models of neisserial infection. J Immunol Methods. 2006;311(1-2):153-63.
Riego E, Limonta J, Aguilar A, Perez A, de Armas R, Solano R, et al. Production of transgenic mice and rabbits that carry and express the human tissue plasminogen activator cDNA under the control of a bovine alpha S1 casein promoter. Theriogenology. 1993;39(5):1173-85.
Toledo JR, Prieto Y, Oramas N, Sanchez O. Polyethylenimine-based transfection method as a simple and effective way to produce recombinant lentiviral vectors. Appl Biochem Biotechnol. 2009;157(3):538-44.
Zhao XM, Quan GB, Zhou GB, Hou YP, Zhu SE. Conventional freezing, straw, and open-pulled straw vitrification of mouse two pronuclear (2-PN) stage embryos. Anim Biotechnol. 2007;18(3):203-12.
Takeo T, Nakagata N. Cryobanking and Recovery of Genetically Modified Mice. Methods Mol Biol. 2020;2066:195-209.
Behringer R, Gertsenstein M, Nagy KV, Nagy A. Administration of Gonadotropins for Superovulation in Mice. Cold Spring Harb Protoc. 2018;2018(1).
Lamas S, Carvalheira J, Gartner F, Amorim I. C57BL/6J mouse superovulation: schedule and age optimization to increase oocyte yield and reduce animal use. Zygote. 2021;29(3):199-203.
Luo C, Zuniga J, Edison E, Palla S, Dong W, Parker-Thornburg J. Superovulation strategies for 6 commonly used mouse strains. J Am Assoc Lab Anim Sci. 2011;50(4):471-8.
Hasegawa A, Mochida K, Inoue H, Noda Y, Endo T, Watanabe G, et al. High-Yield Superovulation in Adult Mice by Anti-Inhibin Serum Treatment Combined with Estrous Cycle Synchronization. Biol Reprod. 2016;94(1):21.
Pu XA, Young AP, Kubisch HM. Production of Transgenic Mice by Pronuclear Microinjection. Methods Mol Biol. 2019;1874:17-41.
Cheng PH, Chang YF, Mao SH, Lin HL, Chen CM, Yang SH. Lentiviral transgenesis in mice via a simple method of viral concentration. Theriogenology. 2016;86(6):1427-35.
Lois C, Hong EJ, Pease S, Brown EJ, Baltimore D. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science. 2002;295(5556):868-72.
Pfeifer A, Hofmann A. Lentiviral transgenesis. Methods Mol Biol. 2009;530:391-405.
Miao K, Guo M, An L, Xu XL, Wu H, Wang D, et al. A new method to efficiently produce transgenic embryos and mice from low-titer lentiviral vectors. Transgenic Res. 2011;20(2):357-63.
Koza P, Przybys J, Klejman A, Olech-Kochanczyk G, Konopka W. Generation of Transgenic Rats using a Lentiviral Vector Approach. J Vis Exp. 2020(159).