Mollicutes asociado a mastitis en rebaños bovinos lecheros en la provincia Zamora-Chinchipe, Ecuador
Contenido principal del artículo
Resumen
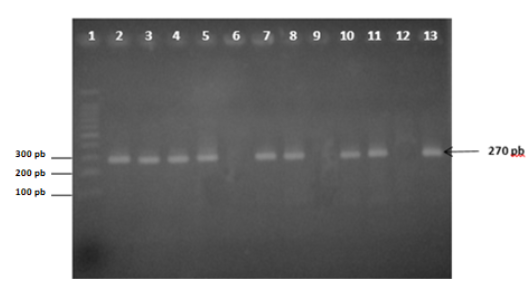
El crecimiento de la población mundial demanda disponibilidad de suficientes alimentos nutritivos e inocuos, y la mastitis bovina es una enfermedad que aún causa grandes pérdidas económicas, además de otros riesgos a la salud de los rebaños y el público en general, pese a los avances tecnológicos y la profundización en el conocimiento de factores decisivos en su comportamiento, dependientes tanto de los hospederos, como de los patógenos involucrados y del ambiente donde su interación tiene lugar. Para profundizar en la asociación de Mollicutes, en los procesos de mastitis en Zamora-Chinchipe se investigaron 386 vacas, de 99 rebaños, de las que 126 resultaron positivas (32,6 %) mediante Reacción en Cadena de la Polimerasa (PCR), en tanto 340 (88,1 %) se constataron con mastitis subclínica mediante Prueba de California para mastitis. Aunque no se evidenció Mycoplasma bovis, otros micoplasmas también patogénicos pudieron estar presentes y complicar la recuperación de los rebaños afectados por la reconocida resistencia de estos microorganismos a la antibioterapia tradicional, entre otros peligros. La no asociación entre los resultados de los métodos de diagnóstico empleados evidenció que otros patógenos estuvieron involucrados en el mosaico etiológico de la mastitis en la provincia y reveló la necesidad de su indispensable profundización para orientar adecuadamente las estrategias de control.
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0) que prohíbe el uso comercial de sus publicaciones y permite a terceros compartir la obra siempre que se indique su autor y la primera publicación en esta revista. Bajo esta licencia el autor será libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
- El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia
Bajo las siguientes condiciones:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
Citas
Zadoks RN, Middleton JR, McDougal S, Katholm J, Schukken YH. Molecular Epidemiology of Mastitis Pathogens of Dairy Cattle and Comparative Relevance to Humans. Mammary Gland Biol Neoplasia. 2011; 16:357-372. DOI 10.1007/s10911-011-9236-y
Boboš S, Radinovic´ M, Vidic´ B, Pajic´ M, Vidic´ V, Galfi A. Mastitis therapy: Direct and indirect costs. Biotechnol. Anim. Husb. 2013; 29, 269-275
Hertl J, Shukken Y, Bar D, Bennett G, González R, Rauch B, et al. The effect of recurrent episodes of clinical mastitis caused by Gram-positive and Gram-negative bacterias and other organism on mortality and culling in Holstein dairy cows. J. Dairy Sci. 2011; 94:4863-4877.
Fernandes I, Guimaraes NR, Noyes LS, Caixeta VS. Effect of subclinical mastitis detected in the first month of lactation on somatic cell count linear scores, milk yield, fertility, and culling of dairy cows in certified organic herds, Journal of Dairy Science. 2021; 104 (2): 2140-2150. https://doi.org/10.3168/jds.2020-19153.
da Silva Bomfim BV, Costa Balieiro A, Messias de Souza Ferreira da Costa AC, Teles Romeiro E, de Souza Franco E, Menezes Wanderley ML et al. Factores de riesgo asociados a la mastitis bovina. Rev. Ibero-Am. de Hum., Ciências e Educ. São Paulo. 2023; 9(3). REASE. http://doi.org/10.51891/rease.v9i3.8958
Awandkar SP, Kulkarni MB, Khode NV. Bacteria from bovine clinical mastitis showed multiple drug resistance. Veterinary Research Communications. 2022; 46(1), 147-158.
Paramasivam R, Raj Gopal D, Dhandapani R, Subbarayalu R, Prabu Elangovan M y col. Is AMR in Dairy Products a Threat to Human Health? An Updated Review on the Origin, Prevention, Treatment, and Economic Impacts of Subclinical Mastitis. Infection and Drug Resistance. 2023; 16.
Dhakal K, Tiezzi F, Clay JS, Maltecca C. Causal relationships between clinical mastitis events, milk yields and lactation persistency in US Holsteins. Livestock Science. 2016; 189, 8-16.
Citti C, Blanchard A. Mycoplasmas and their host: emerging and re-emerging minimal pathogens. Trends in Microbiology. 2013; 21(4):196-203. https://doi.org/10.1016/j.tim.2013.01.003
Ruegg PL. A 100-Year Review: Mastitis detection, management, and prevention. J. Dairy Sci. 2017; 100:10381-10397. https://doi.org/10.3168/jds.2017-13023
Haapala V, Vähänikkilä N, Kulkas L, Tuunainen E, Pohjanvirta T, Autio T, et al. Mycoplasma bovis infection in dairy herds-Risk factors and effect of control measures. J. Dairy Sci. 2021; 104:2254-2265 https://doi.org/10.3168/jds.2020-18814
Justice-Allen A, Trujillo J, Goodell G, Wilson D. Detection of multiple Mycoplasma species in bulk tank milk samples using real-time PCR and conventional culture and comparison of test sensitivities. J Dairy Sci. 2011; 94:34113419
Adorno, BMV, Salina A, Joaquim SF, Guimarães FF, Lopes BC, Menozzi BD, Langoni H. Presença de Mollicutes e Mycoplasma bovis em Swabs Nasais de bezerros e na secreção mastítica de vacas Vet. e Zootec. 2021; 28: 001-009. ISSN Eletrônico 2178-3764
Deeney AS, Collins R, Ridley AM. Identification of Mycoplasma species and related organisms from ruminants in England and Wales during 2005-2019. BMC Veterinary Research. 2021; 17(1):1-12.
Ramírez-Sanmartín N, Luis Rodrigo-Saa, Percedo-Abreu MI, Pérez Castillo A, Lobo-Rivero E. Detección de Mollicutes en leche de tanques procedentes de la provincia Zamora-Chinchipe, Ecuador. Rev. Salud Anim. 2017; 39(3)
Hervada Vidal X, Naveira Barbeito G, Santiago Pérez MI, Mujica Lengua ÓJ, Vázquez Fernández E, Manrique Hernández R et al. Epidat: programa para análisis epidemiológico de datos. Consellería de Sanidade, Xunta de Galicia, España, Organización Panamericana de la Salud (OPS-OMS), 2016. Universidad CES, Colombia.
Saa LR, Perea A, García-Bocanegra I, Arenas AJ, Jara DV, Ramos R, Carbonero A. Seroprevalence and risk factors associated with bovine viral diarrhea virus (BVDV) infection in non-vaccinated dairy and dual purpose cattle herds in Ecuador. Trop Anim Health Prod. 2012; 44:645-649. DOI 10.1007/s11250-011-9948-4
National Mastitis Council (NMC). Golbal Milk Quality. Procedures for Collecting Milk Samples. 2014; http://www.nmconline.org/sampling.htm
Rossetti B, Frey J, Pilo P. Direct detection of Mycoplasma bovis in milk and tissue samples by real-time PCR. Mol Cell Probes. 2010; 24:321-323.
Van Kuppeveld FJM, Johansson KE, Galama JMD, Kissing J, Bölske G, van der Logt JTM et al. Detection of mycoplasma contamination in cell cultures by a mycoplasma group-specific PCR. Applied Environment Microbiol.1998; 60:149-152.
Hotzel H, Heller M, Sachse K. Pfützner H. Rapid detection of Mycoplasma bovis in milk samples and nasal swabs using the polymerase chain reaction. Mol Cell Probes. 1996; 13:175e8
Blowey R, Edmondson P. Somatic cell count. Mastitis Control in dairy herds, (Ed. 2). 2010; 152-170.
Castillo Duvergel Y, Miranda I. COMPAPROP: Sistema para comparación de proporciones múltiples. Rev. Protección Veg. 2014; 29(3): 231-234
Amer S, Gálvez FLA, Fukuda Y, Tada C, Ludeña IL, Valle WFM, Nakai Y. Prevalence and etiology of mastitis in dairy cattle in El Oro Province, Ecuador. J. Vet. Med. Sci. 2018; 80(6):861-868. DOI:10.1292/jvms.17-0504
Cuenca M, García D, Reinoso L, González J, Torracchi J. Detección de Mastitis Subclínica Bovina y factores asociados, en fincas lecheras de la Provincia del Cañar--Biblián, Ecuador. Revista Científica de la Facultad de Ciencias Veterinarias. 2021; 31(3), 93-98.https://doi.org/10.52973/rcfcv-luz313.art3
Wilson DJ, Skirpstunas RT, Trujillo JD, Cavende KB, Bagley CV, Harding RL. Unusual history and initial clinical signs of Mycoplasma bovis mastitis and arthritis in first lactation cows in a closed commercial dairy herd. J Am Vet Med Assoc. 2007; 230:1519-1523.
Kruze J, Mella A. First bovine clinical mastitis outbreak in a large dairy herd in Chile caused by the environmental algae P. zopfii. In Proc XXVI World Buiatrics Congress. 2011
Gioia G, Addis MF, Santisteban C, Gross B, Nydam DB, Sipka AS et al. Mycoplasma species isolated from bovine milk collected from US dairy herds between 2016 and 2019. J. Dairy Sci. 2020; 104:4813-4821. https://doi.org/10.3168/jds.2020-19171
Parker AM, Sheehy PA, Hazelton MS, Bosward KL, House JK. A review of mycoplasma diagnostics in cattle. J Vet Intern Med. 2018; 32:1241-1252. https://doi.org/10.1111/jvim.15135
Manzi MP, Joaquim SF, Guimarães FF, Bruder-Nascimento ACMO, Pantoja JC, Langoni H. Prevalência de Mycoplasma bovis em rebanhos de vacas leiteiras. Pesq. Vet. Bras. 2018; 38(4):665-669. DOI: 10.1590/1678-5150-PVB-5192
Nunes de Morais AC, Regis Pires D, Costa da Cunha N, dos Santos Machado L, Abdalla Helayel M, Monteiro de Mendonça JF et al. Risk factors associated with intramammary colonization with Mollicutes in dairy cattle from Southeast Brazil. Ciência Rural, Santa Maria. 2021; 51:8 http://doi.org/10.1590/0103-8478cr20200694
Salina A, Timenetsky J, Barbosa MS, Azevedo CM, Langoni H. Microbiological and molecular detection of Mycoplasma bovis in milk samples from bovine clinical mastitis. Pesq. Vet. Bras. 2020; 40(2):82-87.
Andrade-Becerra, R. J., Caro-Carvajal, Z., Pulido-Medellín, M., López-Cepeda, M. Prevalencia de Mycoplasma spp., en fincas lecheras del Altiplano Boyacense (Colombia). Revista UDCA Actualidad & Divulgación Científica. 2014; 17(2), 461-466.
Ulloa, F., Soto, J.P., Kruzea, J., Mella, A. Mycoplasma isolation in milk samples from dairy herds in Chile. Austral J Vet Sci. 2021; 53:109-113
Maunsell F, Donovan A. Mycoplasma bovis Infections in young calves. Vet Clin Food Anim. 2009; 25:139-177.
Hazelton MS, Morton JM, Parker AM, Bosward KL, Sheehy A, Dwyer CJ, et al. Mycoplasma bovis and other Mollicutes in replacement dairy heifers from Mycoplasma bovis-infected and uninfected herds: A 2-year longitudinal study. J. Dairy Sci. 2020; 103:11844-11856. https://doi.org/10.3168/jds.2020-18921
Barkema HW, Schukken YH, Zadoks RN. Invited review: The role of cow, pathogen, and treatment regimen in the therapeutic success of bovine Staphylococcus aureus mastitis. J. Dairy Sci. 2006; 89:1877-1895.
De Schutter L. Mycoplasma bovis alsveroorzaker van acute uierontsteking. Epidemiologis chonderzoek op 2 positieve melk veebedrijv en Katholieke Hoge school Kempen, Campus Geel, Belgium. 2010
Maunsell FP, Woolums AR, Francoz D, Rosenbusch RF, Step DL, Wilson DJ, Janzen ED. Mycoplasma bovis Infections in Cattle. J Vet Intern Med. 2011; 25:772-783
Fujimoto Y, Ito H, Higuchi H, Ohno H, Makita K. A case-control study of herd- and cow-level risk factors associated with an outbreak of Mycoplasma mastitis in Nemuro, Japan. Preventive Veterinary Med. 2020; 177, 104946. https://doi.org/10.1016/j.prevetmed.2020.104946
Dudek, K.; Szacawa, E.; Nicholas, R.A.J. Recent Developments in Vaccines for Bovine Mycoplasmoses Caused by Mycoplasma bovis and Mycoplasma mycoides subsp. mycoides. Vaccines. 2021, 9, 549. https://doi.org/10.3390/vaccines9060549