Toxicidad aguda extendida por vía intranasal de SURFACEN® en ratas
Contenido principal del artículo
Resumen
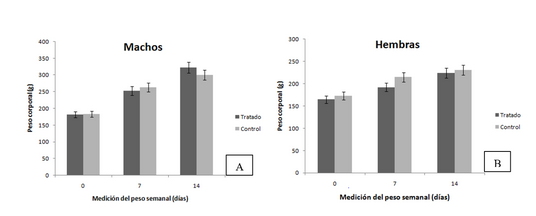
Los estudios de irritabilidad local para los productos inhalados constituyen un eslabón fundamental en la cadena de requisitos regulatorios de los estudios preclínicos toxicológicos, por este motivo el objetivo del trabajo fue determinar el potencial irritante de SURFACEN® en dosis repetidas por vía intranasal. Se utilizaron 30 ratas Cenp: Sprague Dawley (15 de cada sexo) distribuidas en dos grupos experimentales: control (solución de NaCl 0,9 %) y tratado (SURFACEN®). Ambos grupos recibieron el mismo esquema de tratamiento con dos aplicaciones diarias espaciadas entre sí, de cuatro a seis horas por vía intranasal, durante 14 días. La dosis a aplicar fue de 13,27 mg/kg. Las variables a evaluar fueron la observación clínica, el peso corporal, el peso corporal post mortem, el peso absoluto y relativo de los órganos seleccionados (pulmones, encéfalo) de cada animal y los estudios anatomopatológicos. El diseño y la conducción de la investigación se realizó según los principios de bienestar animal. Todos los animales sobrevivieron al estudio. No se evidenciaron diferencias estadísticamente significativas entre ambos grupos en las variables estudiadas. No hubo signos de toxicidad manifiestos tras la administración de SURFACEN® y no se detectaron alteraciones anatomopatológicas que pudieran estar asociadas a la administración del medicamento. Se evidenció que la aplicación de dosis repetidas por vía intranasal de SURFACEN® no alteró la morfología celular de la mucosa nasal, no causó daños histopatológicos en los órganos estudiados y no produjo signos de irritación local, por lo que se considera potencialmente no tóxico para humanos.
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0) que prohíbe el uso comercial de sus publicaciones y permite a terceros compartir la obra siempre que se indique su autor y la primera publicación en esta revista. Bajo esta licencia el autor será libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
- El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia
Bajo las siguientes condiciones:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
Citas
García Cases S, Caro Aragonés I, Aguinagal de Toya A, Gaspar Carreño M, Marquez Peiró JF. Dispositivos y guía de administración vía inhalatoria. ILAPHAR Rev. OFIL. 2017;27(1):31-46. Disponible en: https://www.ilaphar.org/dispositivos-guia-administracion-via-inhalatoria/
Bautista-Méndez R, Salinas-Lezama E, Bonola-Gallardo LJ, Pineda-Gudiño RD, Magdaleno-Maldonado GE. Selección en la diversidad de inhaladores: una actualización de bolsillo. Neumol Cir Torax. 2020;79(3):204-207. Disponible en: https://dx.doi.org/10.35366/96657
Anderson S, Atkins P, Beackman P, Cipolla D, Clark A, Daviskas E, et al. Inhaled Medicines: Past, Present, and Future. Pharmacol Rev. 2022;74(1):48-118. Disponible en: https://doi.org/10.1124/pharmrev.120.000108
Díaz-Casañas E, Morilla Gúzmán A, Rodríguez Moya V, Barrese Pérez Y. Estrategia de desarrollo clínico para la evaluación de la eficacia y seguridad de SURFACEN®. Rev Arch Med Camagüey. 2019;23(4):455-463. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-02552019000400455
Díaz-Casañas E, Rodríguez Moya V, Montes de Oca Martínez N. Surfactante pulmonar: posible intervención frente al nuevo Síndrome Respiratorio Agudo Severo Coronavirus 2 (SARS-CoV-2). Rev Habanera Cienc Médi. 2020;19:1-5. Disponible en: http://www.revhabanera.sld.cu/index.php/rhab/article/view/3361
Blanco O, Ramírez W, Lugones Y, Díaz E, Morejón A, Rodríguez V, et al. Protective effects of Surfacen® in allergen-induced asthma mice model. Int Immunopharmacol. 2022;102. Disponible en: https://doi.org/10.1016/j.intimp.2021.108391
Comisión Europea. Anexo 5 Parte B: Métodos para la determinación de la toxicidad y otros efectos sobre la salud. The Directive on Dangerous Substances. 2019. Disponible en: https://ec.europa.eu/environment/archives/dansub/pdfs/annex5b_es.pdf
Willson DF. Aerosolized Surfactants, Anti-Inflammatory Drugs, and Analgesics. Respir Care. 2015;60(6):774-790; Disponible en: https://doi.org/10.4187/respcare.03579
Center for Drug Evaluation and Research (CDER). Guidance for Industry Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers. Pharmacol Toxicol. July 2005. Disponible en: https://www.semanticscholar.org/paper/Guidance-for-Industry-Estimating-the-Maximum-Safe-Alert/8750b5d4c6564d44ac84826e3760f15ea0b836de
Derelanko MJ, Auletta CS. Handbook of Toxicology. Third Edition 2014 ISBN 9781439890134. Published March 7, 2014 by CRC Press 1024 Pages 7 Color & 340 B/W Illustrations.
European Agency for the Evaluation of Medicinal Products. Guideline on non-clinical local tolerance testing of medicinal products. EMEA/ CHMP/SWP/2145/2000. 1-9. 2015, London.
Guías para la eutanasia de los animales 2020 AVMA. https://www.portalveterinaria.com/upload/202002070922022020_Euthanasia_Final_1-15-20.pdf
Aller Reyero MA, Rodríguez Gómez J, Rodríguez Fabiána G. Normas éticas para el cuidado y utilización de los animales de experimentación. Rev Cirugía Esp. 2000;67(1):10-13. https://www.elsevier.es/es-revista-cirugia-espanola-36-articulo-normas-eticas-el-cuidado-utilizacion-8848
Morilla GA, Díaz-Casañas E, Ávila AY, Barrese PY, Fernández LO, Uranga PR. Seguridad del tratamiento con Surfacen® en recién nacidos pretérminos con síndrome de dificultad respiratoria. Rev Cubana Pediatr. 2019;91(2):1-14. Disponible en: http://www.revpediatria.sld.cu/index.php/ped/article/view/700/315
Barrese PY, Lim AN, Díaz-Casañas E, Uranga PR, Ávila AY. Evaluación de la seguridad del uso poscomercial del surfactante cubano, SURFACEN®, en el tratamiento del síndrome de dificultad respiratoria aguda del adulto. Neumol Cir Torax. 2019;78(3):296-303. DOI:10.35366/NT193F
Rodríguez-Moya VS, Barrese-Pérez Y, Uranga-Piña R, Díaz-Pérez L, Verdecia-Sánchez L, Díaz-Casañas E. Seguridad del tratamiento con surfactante pulmonar en el síndrome de dificultad respiratoria aguda en niños. Rev haban cienc méd 2022; 21(1). http://www.revhabanera.sld.cu/index.php/rhab/article/view/4362
Alemán C. Reference data base for the principal physiological indicators in species of laboratory animal. Lab Anim. 2000;34(1):358-378. DOI:10.1258/002367700780387741
Taconic Technical Library. [Homepage on the internet]. Cambridge: Taconic Sprague Dawley, Growth and Phenotyping Data; 2018. http://www.taconic.com/rat-model/sprague-dawley
Rosario Fernández LA, Tamargo Santos B, Batista Santiesteban N, Infante Bourzac JF, Sierra GonzálesVG, Arencibia Arrebola DF, et al. Estudio de tolerancia local de un candidato vacunal proteoliposómico contra Leptospira spp en el biomodelo Mesocricetus auratus. Theoria. 2012; 21(1):21-36. Disponible en: https://www.redalyc.org/articulo.oa?id=29931769003
Oliva-Hernández R, Fariñas-Medina M, Infante-Bourzac JF, Hernández-Salazar T, Núñez-Martínez D, Quintero-Pérez A, et al. Estudio de tolerancia local de la vacuna antimeningocóccica VA-MENGOC-BC® en ratas Sprague Dawley. Evaluación a los 24 y 36 meses en estante VacciMonitor. 2019;28(1):9-18. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-028X2019000100009&lng=es
Paixao A, Mancebo B, Regalado AI, Chong D, Sánchez LM. Evaluación de la Toxicidad Aguda Oral del extracto etanólico de Tephrosia vogelii Hook (kalembe). Rev Salud Animal. 2017; 39(2). http://revistas.censa.edu.cu/index.php/RSA/article/view/895/876
Infante JF, Sifontes S, Pérez V, Bracho G, Hernández T, Zayas C, et al. Ensayo de inmunogenicidad y toxicidad local del cocleato de Neisseria meningitidis en ratas Sprague Dawley. VacciMonitor. 2009;188(1):1-7. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-028X2009000100001
Greaves P. Histopathology of Preclinical Toxicity Studies. Interpretation and Relevance in Drug Safety Evaluation. 4th Edition - October 7, 2011, Elsevier. United Kingdom. eBook ISBN: 9780444538611. Hardcover ISBN: 9780444538567. Disponible en: https://www.elsevier.com/books/histopathology-of-preclinical-toxicity-studies/greaves/978-0-444-53856-7
Draft OECD Guidance Document on Histopathology for inhalation toxicity studies, Supporting TG412 (Subacute Inhalation Toxicity: 28-Day) and TG 413 (Subchronic Inhalation Toxicity: 90-Day). Version 28, September 2009. Disponible en: https://ntp.niehs.nih.gov/iccvam/suppdocs/feddocs/oecd/oecd-gd125.pdf
Oros Pantoja R. Efecto del estrés sobre el tejido linfoide asociado a nariz en el ratón. 2011. http://www.repositoriodigital.ipn.mx/handle/123456789/12086
Takaki H, Ichimiya S, Matsumoto M, Seya T. Mucosal Immune Response in Nasal- Associated Lymphoid Tissue upon Intranasal Administration by Adjuvants. J Innate Immun. 2018;10:515-52. DOI: 10.1159/000489405