Presence of phytopatogenic fungi in seeds of different cultivars of Phaseolus vulgaris L. in the province of Cienfuegos, Cuba
Main Article Content
Abstract
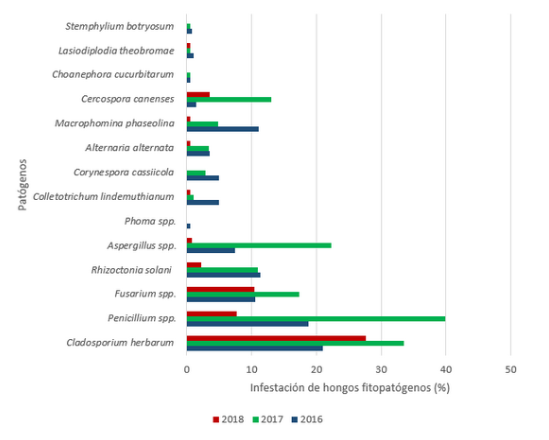
The research was carried out at the Cienfuegos Provincial Plant Health Laboratory from 2016 to 2018 with the aim of determining the presence of phytopathogenic fungi on seeds of different common bean cultivars (Phaseolus vulgaris L.). For this, six cultivars of black testa, eight of red testa and two of white testa were evaluated. The incidence of fungi was determined by processing the samples by means of the biological test method of growth in a humid chamber and identifying them following the diagnostic keys of the CMI (Commonwealth Mycological Institute). In 2016, 14 fungal pathogens were detected with the highest incidence of Cladosporium herbarum (Pers.) Link (21 %), Penicillium sp (18,8 %), Rhizoctonia solani Kühn (11,4 %), Macrophomina phaseolina (Tassi) Goid (11,04 %) and Fusarium spp. (10,6 %). In 2017, there were 13 identified fungi, standing out Penicillium spp (39.9 %), C. herbarum (33,5 %), Aspergillus spp (22,3 %), Fusarium spp. (17,3 %), Cercospora canenses Ellis & G. Martin (13 %), and R. solani (11 %). Finally, 10 fungi were identified in 2018, and the highest percentages were shown by C. herbarum (27,7 %), Fusarium spp. (10,5 %), Penicillium spp (7,7), and, to a lesser extent, R. solani (2,2 %). In all the years studied, the infection by Fusarium spp. was outstanding in the cultivars ´CUL-156´, ´BAT-93´, and ´Delicias-364´, while R. solani incidence was higher in the cultivars ´Delicias-364´, ´Velazco Largo´, ´CC-25-9R´, ´La Cuba -154´, and ´CUL-156´, showing this latter cultivar the same high susceptibility to both pathogens.
Article Details

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0) que permite a terceros compartir la obra, siempre que se indique su autor y la primera publicación en esta revista. Bajo esta licencia el autor será libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
- El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia
Bajo las siguientes condiciones:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
References
Boicet FT, Secada Y, Chaveco O, Boudet A, Gómez Y, Meriño Y, et al. Respuesta a la sequía de genotipos de fríjol común utilizando diferentes índices de selección. Centro Agrícola. 2011; 38(4):69-73.
Ghangaokar NM, Kshirsagar AD. Study of seed borne fungi of different legumes. Trends in Life Sciences 2013; 2(1):32-35.
Martínez de la Parte E, Cantillo T, García D. Hongos asociados a semillas de Phaseolus vulgaris L. cultivadas en Cuba. Biotecnología Vegetal. 2014; 14(2):99-105.
Calatayud P. Compuestos fenólicos y flavonoides como marcadores bioquímicos de la respuesta a estrés abiótico en plantas tolerantes. Universidad Politécnica de Valencia, Gandia. 2010. http://hdl.handle.net/10251/9179
Winkel-Shirley B. Biosynthesis of flavonoids and effects of stress. Curr. Opin. Plant Biol. 2002; 5:218-223.
González M. Enfermedades fungosas del frijol en Cuba. La Habana: Editorial Científico - Técnica. 1988: 152 p.
Sandoval I, López MO. Micobiota del cultivo del frijol (Phaseolus vulgaris L.) en Cuba. Fitosanidad. 2000; 4(3-4):15-21.
Díaz M, Quintero E, Bernal A, Reinaldo Y. Las enfermedades causadas por hongos del suelo en el cultivo del frijol común (Phaseolus vulgaris L.). Centro Agrícola. 2005; 32(3):43-46.
Nerey Y, Pannecoucque J, Hernández HP, Díaz M, Espinosa R, De Vos E, et al. Rhizoctonia spp. causing root and hypocotyl rot in Phaseolus vulgaris in Cuba. Journal of Phytopathology. 2010; 158:236-243.
ISTA. International rules for seed testing. Seed Science Technology.1996; 24: 1-335
Ferry Lane K. Descriptions of Pathogenic Fungi and Bacteria. Commonwealth Mycological Institute (CMI).1974; No.41:401-410.
Mercado A. Hifomicetes y Demaciaceos de Sierra del Rosario, Cuba. La Habana: Editorial Academia. 1984: 1-178.
Arnold RWG. Lista de hongos fitopatógenos de Cuba. La Habana: Editorial Científico - Técnica. 1986:1-206.
Splieger MR. La media, la mediana y otras medidas de tendencia central. En: Teoría y problemas de estadísticas. Novena Edición. Guantánamo: Editorial Revolucionaria. 1989: 45-68.
Castellanos M. Incidencia de Rhizoctonia spp., Sclerotium rolfsii y Macrophomina phaseolina en frijol común en Villa Clara. Bases para el Manejo Integrado. [Tesis en Opción al Grado Científico de Doctor en Ciencias Agrícolas]. Universidad Central “Marta Abreu” de las Villas, Villa Clara; Cuba. 2011.pp.136.
INTA. Catálogo de hongos en semillas de frijol (Phaseolus vulgaris L.) en Nicaragua. 2013. http://www.inta.gob.ni/biblioteca/images/pdf/manuales_catalogos/Guia%20Catalogo%20identificacion%20de%20hongos%20en%20semillas%20de%20frijol.pdf
Campos AJ. Enfermedades del frijol. México: Trillas. 1991:154-167.
López FL. Definición de prioridades de investigación fitopatológica para la zona templada del Altiplano Central de México. Agricultura Técnica México. 1991;17(1 y 2):17-51.
Keinath AP, Batson JrE, Caceres J, Elliott ML, Sumner DR, Brannen PM, et al. Valuation of biological and chemical seed treatments to improve stand of snap bean across the Southern United States. Crop Protection. 2000; 19:501-509.
Sánchez M, García I, González I, Fernández J. Evaluación de plagas y enfermedades en el cultivo del frijol caupí (Vigna unguiculata L. Walp.) en la región occidental de Cuba. En: Taller Científico Técnico Nacional por el V Aniversario de la Estación Territorial de Investigaciones Agropecuarias de Holguín (ETIA-H) MINAGRI. 1992: 22.
Herrera L. Los hongos fitopatógenos el suelo en Cuba. [Tesis en Opción al Grado científico de Doctor en Ciencias Agrícolas]. Universidad Central “Marta Abreu” de las Villas, Villa Clara. Cuba. 2004:pp. 266.
López V. Hongos asociados al cultivo del frijol Caupì (Vigna unguiculata L. Walp) y comportamiento de Rhizoctonia solani Kühn en agroecosistemas de la Provincia Holguín. [Tesis en Opción al grado científico de Máster en Ciencias Agrícolas]. Universidad de Holguín, Holguín. Cuba. 2005:pp.80.
Herrera L, Camara M, Galantai E. Bioecología y Métodos de lucha contra hongos fitopatógenos del suelo en Cuba (I). Monografía. Universidad Central de las Villas. 1988:pp.68.